俄罗斯医疗器械市场准入要求
一、医疗器械监管机构
俄罗斯注册和批准医疗器械和体外诊断器械主要由俄罗斯医疗服务监管局(Federal Service for Surveillance in Healthcare, Roszdravnadzor )负责。此外,从事医疗器械监管的俄罗斯政府部门还包括Gosstandart和Rospotrebnadzor。俄罗斯医疗服务监管局下属两个机构:医疗器械注册与控制部门(Medical Device Registration and Control Department)和国家质量机构(National Institute for Quality, FGBU)。医疗器械注册与控制部门负责医疗器械注册、变更和修改的审批,并对获批产品发放注册证;国家质量机构FGBU负责对产品的质量管控。
总体而言,获得俄罗斯医疗器械注册证有两个路径:1)俄罗斯RZN国家(过渡期截止至2025年12月31日);2)欧亚经济联盟(EAEU)注册;
· 注册官网:
1)RZN
2)Eurasian Economic Commission (EEC)
二、主要法规
· Article 38 of the Health Law (Federal Law 323)(注:俄罗斯将于2026.1.1开始转换为EAEU(Eurasian Economic Union States)欧亚经济联盟注册路径,意味着该法规将同步转换成欧亚联盟注册法规)
· Decree No. 1416 Medical Device Registration Rules (1416号决议及其补充决议:注册要求)
· Ministry of Health of the Russian Federation Order No.2n of January 9, 2014 on Approval of the Procedure for Medical Device Conformity Assessment in the Form of Technical Trials, Toxicological Studies and Clinical Trials for Medical Device State Registration Purposes (技术测试、毒理测试和临床试验要求)
· Ministry of Health of the Russian Federation Order No.4n of June 6, 2012 on Approval of the 俄罗斯Medical Product Nomenclature Classification (医疗器械分类与命名规则)
· Ministry of Health of the Russian Federation Order No.11 of January 19, 2017 on Approval of Requirements to
the Content of Technical and Operational Documentation issued by a Producer (manufacturer) of a Medical Device(技术文档及用户文档的要求)
· Ministry of Health of the Russian Federation Order No. 1353n dated December 21, 2012 on Approval of the Procedure for Medical Product Quality, Efficacy and Safety Review (医疗产品质量、疗效和安全性评估程序)
此外还有下列官方发布的适用法规
三、 俄罗斯医疗器械市场准入的注册流程
俄罗斯医疗器械注册特点:
* 俄罗斯依赖产品测试且全部由其国内机构执行的测试或试验来确定几乎所有医疗器械产品的安全性和有效性。这主要是因为俄罗斯针对器械开发了自己的国家标准。而且针对已经获得欧盟CE认证、美国FDA510k认证或其他国家注册审批的器械,甚至是在美国和欧盟市场销售多年的产品同样也需要按照俄罗斯国家标准完成产品测试。
* 俄罗斯产品注册文件使用的语言要求必须为俄语。
* 俄罗斯产品注册需要委托一名俄罗斯当地授权代表代理其完成相关程序。
* 俄罗斯器械注册通过监管机构Roszdravnadzor完成且基于测试结果。根据俄罗斯法规,所有测试必须由当地专业测试中心和医院完成(Roszdravnadzor在其官网公布了相关可以完成测试的机构名单),且测试结果必须包含在注册申报文件中。负责俄罗斯器械注册监管的机构主要有三个:
- Roszdravnadzor 该名称是俄罗斯控制医疗和社会发展联邦服务部门(Federal Service for Control of Healthcare and Social Development)的简称。该机构负责监管俄罗斯所有国内和进口医疗器械。其管理和控制注册程序、审批或拒绝医疗器械注册申请,且致力于确保医疗器械和医疗设备的临床安全性和有效性。
- Gosstandart 全称为技术合规和计量联邦代理机构(Federal Agency for Technical Regulation and Metrology)。该机构确保进口至俄罗斯的医疗设备符合俄罗斯标准。其负责签发GOST-R证书。
- Rospotrebnadzor 注意其名称不要与第一个机构Roszdravnadzor混淆,其全称是消费者权利和福利保护监督联邦服务(Federal Service for Supervision in the Area of Consumer Rights and Welfare Protection)。该机构确保与人体接触或会对患者、医生产生不良影响的产品符合俄罗斯卫生和流行病学法规。该机构签发卫生-流行病学正面(卫生证)。
* 俄罗斯医疗器械注册最重要的变化就是2024年1月1日开始实施递交注册申请之前的质量管理体系强制性核查。2023年期间,提交的注册将会在3年执行首次现场审核。
* 俄罗斯注册证永久有效(出现严重违规被吊销除外);2025年12月31日之前提交俄罗斯注册会予以受理;2026年12月31日之前,可发起RZN注册变更;2027年1月1日起,俄罗斯注册窗口关闭,不可变更,变更需走EAEU路径。
俄罗斯医疗器械注册流程概述
* 第一步也是最重要一步:在俄罗斯医疗服务监管局(Federal Service for Surveillance in Healthcare, Roszdravnadzor)网站完成注册申请。在此过程中,器械通常会进行安全性和生物兼容性技术检测,之后完成临床评价。所有在俄罗斯注册的医疗器械会被纳入俄罗斯产品分类系统并分配给某个特定产品代码。该代码将在注册证书中引用。医疗器械根据各自产品代码,会豁免或加征10%或18%增值税。
* 第二步,获得由俄罗斯具有认证资质的机构签发的符合性声明。注册证和符合性声明为俄罗斯海关和器械销售强制要求提交的进口文件。
* 为完成第一步医疗器械的技术检测,需获得Roszdravnadzor签发的进口医疗器械样品的特别许可。完成测试之后,提交产品相关注册文档至Roszdravnadzor完成技术审评。
* 技术文档将提交Roszdravnadzor完成审评。Roszdravnadzor根据器械分类将其分配给不同的专家组完成评价。技术专家评价技术文档和测试结果后做出是否需要进行临床试验和临床试验范围如何的结论。完成临床试验后,临床文件必须提交至监管当局Roszdravnadzor。Roszdravnadzor会指派独立专家进行临床文件评价并通知相关评价结果。如果医疗器械视为安全和有效,俄罗斯监管当局将签发注册证并将该器械纳入其医疗器械注册数据库。
* 代替GOST-R证书的符合性声明仅可签发给位于俄罗斯境内的公司(通常是制造商在俄罗斯境内设立的经销商或分支机构)。符合性声明证明医疗器械符合所有适用技术要求和标准。申请人需向俄罗斯认证机构申请此符合性声明。俄罗斯认证机构评估其测试报告和器械制造商与制造商在俄罗斯设立的当地代理之间合同协议,以验证这些材料完整性、准确性。如果情况符合,则签发符合性声明。此符合性声明需由申请人签字且由认证机构完成注册登记。获得此符合性声明后,会在器械上加盖GOST-R认证标识。有源医疗器械需要根据TR CU 20/2011从欧亚联盟处获得额外的符合性声明。器械需要完成电磁兼容性测试并在测试通过后贴上欧亚联盟符合性符号“EAC”。(GOST-R自愿性证书由制造商根据自身情况自愿选择申请。其可证明器械符合器械相关的GOST-R标准,有助于器械在俄罗斯市场的上市销售,有效期为1-3年。获得该证书后,器械会贴上“PTC”的认证标识。)
俄罗斯医疗器械注册时间周期和成本
整个俄罗斯医疗器械注册周期为4-12月。审批专家通常会在面对面会议中确定费用。因而,制造商在俄罗斯当地设立代理人十分关键。
常规医疗器械整个注册文件准备、测试、翻译、公证/海牙认证,和其他咨询费用通常需要14000美元至16500美元,复杂设备达28000美元。实际成本需要视情况而定。
俄罗斯医疗器械注册分类

俄罗斯医疗器械技术测试申请样品进口许可
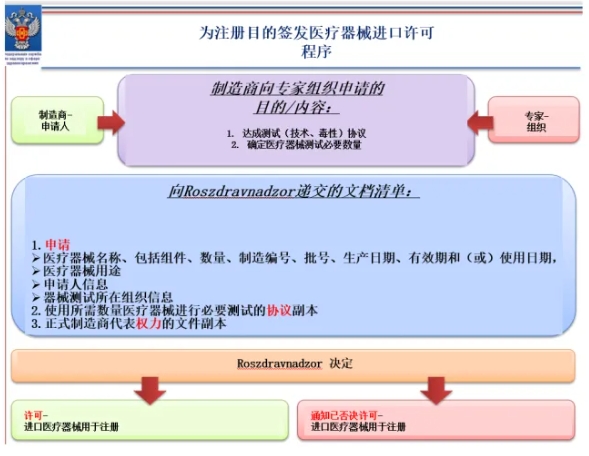
俄罗斯医疗器械注册程序流程图(官网发布)
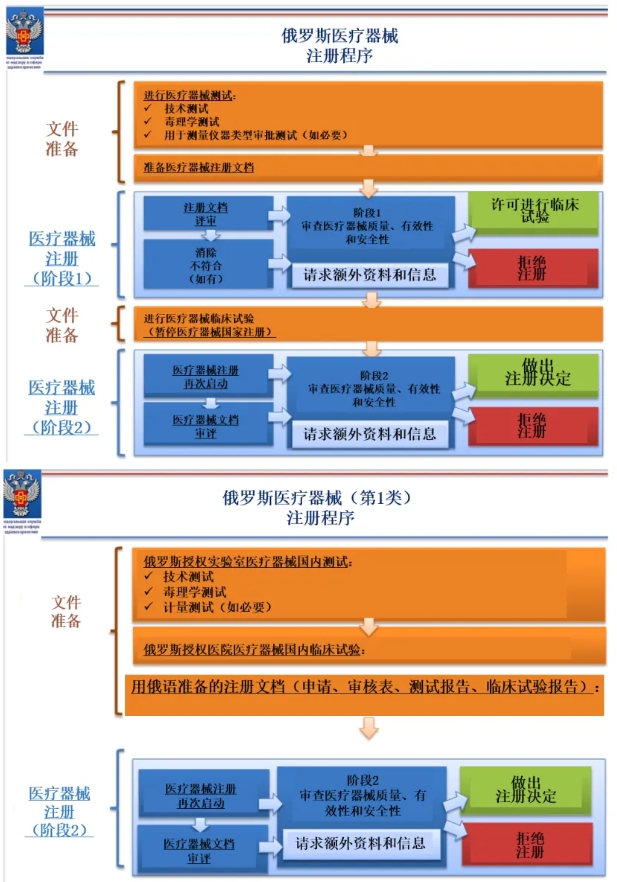
俄罗斯医疗器械注册程序:
1. 确定俄罗斯授权代表,签署授权协议(1-3工作日)
2. 确定俄罗斯境内是否已注册有等同器械(如有,须准备等同性证明文件),证实器械等级。(1个工作日)
3. 约见注册审批专家,确定产品的测试要求,并签署测试合同。(10-15工作日)
4. 申请医疗器械测试样品的进口许可 (10-15工作日)
5. 在俄罗斯境内政府授权测试和医学中心进行测试,接收测试结果和医学报告。(10天-4个月)
6. 准备注册文档,包括测试结果和医学报告,且如果为等同器械注册,还应包含注册器械与等同器械功能特征的对比表。如果某些器械特征与等同器械不同,则还应提供相关合理性依据,说明为什么差异不会影响器械的有效性或安全性。(30-50工作日)
7. 提交所有文档至监管机构,进行RZN阶段1审核。备注:class 2a/2b/3: 根据阶段1审核情况,可能要求补充额外临床数据,此时注册进入“suspended”状态(2-3个月)
8. 一审发布回复:根据一审情况,回复审核意见,补充临床资料(3-12个月)
9. 现场体系审核:对于IIa灭菌、IIb、III类产品,2024年起需进行现场体系审核(3-5个月)
10. 阶段2审核:递交新的临床数据后,进入阶段2审核(2-3个月)
11. 审核通过,RZN颁发注册证书并在RZN数据公示(10-15工作日)
12. 向Rospotrebnadzor申请卫生证(适用产品见下文“卫生-流行病学结论证明(卫生证)”) (1-2个月)。
13. 向Gosstandart申请GOST-R证书或EAC认证, 获取DOC证书(符合性声明) (约1个月)。
14. 提供注册证、卫生证(如适用)和GOST-R证书,再附上其他特定国际商运文件(如,货船海关声明和符合俄罗斯标准和法规的符合性声明)器械可进口至俄罗斯。
注:
1)所有医疗产品注册的文档和信息都需采用俄语提供。因此如委托书、自由销售证书、国外政府证书签发证书、公司营业执照,ISO证书和其他证书必须加盖公证处公章和完成海牙认证。必须提供原件且附上翻译成俄语的公证件。有些文件需要申请人签字和盖章。
2)完成注册后,所有医疗器械设备和器械会被纳入Roszdravnadzor网站医疗产品数据库,产品注册证编号和日期会在器械包装、标签和说明书上显示,且也会在针对终端客户的产品广告中公布。
3) 注册证长期有效。
俄罗斯医疗器械注册文件完整性的要求:
· 申请表。申请表需包含下列内容,申请人应在有公司抬头的纸张上显示下列信息:
- 申请人(授权代表)法定名称、法律实体形式、地址、合同电话、传真和电子邮箱;
- 制造商名称、法律实体形式、地址、合同电话、传真和电子邮箱;
- 器械名称(包含器械预期使用时的配件)
- 器械预期使用范围
- 器械类别
- 由申请人签字的医疗产品正确使用可能产生不良影响的责任确认函
- 侵犯他人在俄罗斯生产、进口和销售医疗产品的权利的责任确认函
- 预估的医疗产品潜在风险等级
- 已批准在俄罗斯销售的等同器械信息(如有)
(如果申请人非俄国公民,则该申请应由该国驻俄罗斯领事馆进行公证和使馆认证。)
* 器械信息表。该表格应提供医疗器械预期用途和基本特征的信息。
* 证明制造商在原产国已注册的文件。通常采用的此类文件是营业执照。此文件必须由该国驻俄罗斯领事馆进行公证和使馆认证。
* 申请人委托函。制造商必须正式授权代理人或经销商从事俄罗斯医疗器械注册。此文件必须由该国驻俄罗斯领事馆进行公证和使馆认证。
* 证明医疗器械的生产符合俄罗斯法律的文件。该文件用于证明制造商国内生产符合生产工艺要求。此类文件的例子包括ISO证书、CE认证证书和自由销售证书。此类文件必须由该国驻俄罗斯领事馆进行公证和使馆认证。
* 起草的合规文件,同时附有医疗器械符合俄罗斯要求、技术条件或标准的证明。
* 医疗器械或体外诊断医疗器械使用说明书。
* 与已在俄罗斯注册销售的等同器械具有等同性的证明文件。
* 测试结果。这包括技术测试、安全性评价(毒理学、电磁兼容)和从两个不同的各自独立的医院或诊所提供的医疗器械有效性和安全性的临床试验。此类文件必须由申请人、医学中心和医院签字和盖章。
* 器械照片(至少18cm*24cm)。
* 广告、促销材料
* 所有提供文档的目录
* 产品样品(如需)
俄罗斯医疗器械注册测试要求详述
为使医疗器械顺利从俄罗斯海关清关,器械制造商必须持有一种或两种下列证书。这些证书仅在获得注册证之后才能签发:
l 卫生—流行病学结论证明(卫生证);
l GOST-R质量证书。
俄罗斯器械注册依赖产品测试,因此必须进口实际产品样品。为此,制造商或申请人必须向Roszdravnadzor提交申请并获得进口许可。一旦收到样品,则应递交此产品样品及其必要文档至授权的医学中心和医院,以进行医疗器械所需的测试和完成医学报告。技术测试和毒理学测试一经完成且通过,则医学报告即可完成。该报告应由Roszdravnadzor授权的两家不同且各自独立的医院或诊所完成。该阶段也可称为预递交。在确定测试前授权评审专家和申请人应进行面对面交流。
Rospotrebnadzor要求须对会与人体/皮肤直接接触和可能会对患者或医生造成不良影响的器械进行卫生测试。在完成相关技术和毒理学测试之后,Rospotrebnadzor内部的国家卫生和流行病监测部门签发一个卫生学-流行病学结论证明(卫生证)。具有测量功能的器械会进行专门测试,以证实其可以用于测量。
一旦收到授权医学中心和医院提供的所有测试和医学报告,则这些文件将同其他注册所需文档合在一起并提交至Roszdravnadzor。此时,申请人必须与Roszdravnadzor内部的国外医疗设备和器械注册部的官员进行面对面交流并提交注册文档。该部门将对注册文档进行审批并决定是否接收此文档用于注册。
如果Roszdravnadzor对根据类型一注册程序提交的注册文档内容满意,该注册文档包含等同器械对比信息,则会签发此产品的注册证。对于类型二程序下的产品,会需要额外专业审评。Roszdravnadzor会指定某一授权医学中心来执行某个医疗器械的质量和/或有效性和/或安全性。如有必要,产品会再测试。如果测试结果通过,则签发注册证;如果测试结果不通过,则拒绝注册的通知会发送给申请人,同时说明拒绝理由。
卫生-流行病学结论证明(卫生证)
与人体/皮肤直接接触和会对患者或医生造成不良影响的器械(如, 心电电机、植入物、 绑带、注射器、针头,麻醉-呼吸一次性产品、 输注治疗的一次性产品和设备,X-射线装置)必须获得卫生-流行病学结论,通常称为卫生证。此测试证实产品符合俄罗斯适用的卫生标准和卫生法规。鉴于对于哪种产品“会不利影响”患者或使用解释会视情况有所不同,目前尚未发布符合此标准的相关产品清单。因而,如果产品接触皮肤不明显,通常需要咨询Rospotrebnadzor以确定是否需要卫生证。卫生证仅由Rospotrebnadzor的两个独立部门负责:
l 卫生和流行病中心。该部门评价测试方案、支持文档和进行测试。
l Rospotrebnadzor区域办公室。该办公室基于卫生和流行病学中心的专家结论(前提是产品符合俄罗斯卫生要求)签发最终的证书。
对于大多数产品,卫生证的有效期是5年,但某些产品必须每年更新注册证。卫生证可以按经销商的名义签发,但是制造商为持有人。获得卫生证的流程通常为1-2个月。
制造商可以申请查验所有生产设施以便为所有产品签发一个卫生证。查验会关注最终产品的生产条件、原材料质控、技术工艺和安全性/卫生参数。
GOST-R质量证书
GOST-R证书类似于CE证书且其签发给制造商以证实进口产品符合俄罗斯国家质量标准。产品必须通过由GOST-R系统认证的俄罗斯当地检测机构进行的测试。关于获得此证书,需要提交额外文档(如,手册、产品描述、测试方案、国际实验室测试报告、国际监管机构的安全性证书、ISO13485证书、符合性声明并附有产品编码和产品名称清单,使用说明书和风险分析)。
证书通过后,器械必须贴有GOST-R符号(符合性标识),表明器械已符合适用的俄罗斯标准。GOST-R证书由经Gosstandart认证的某一测试中心签发,有效期为一年(对于一份合同下的单批次或多个批次),或者如果Gosstandart专家访问或评估了国外生产商在其原产国的生产场地,则有效期为三年。GOST-R证书通常需要在注册签发后的4-6周后可获得。
列入强制性GOST-R认证(强制性产品清单)的器械必须持有GOST-R符合性证书;而未列入该清单的产品参加自愿性GOST R认证,获得相关认证机构符合性声明。
大部分需要获得GOST-R证书和卫生证的制造商,需要递交的文件很多都互相重叠。
俄罗斯医疗器械注册上市后监督
* 产品在俄罗斯国内上市后,相关责任方应及时登录注册官网的医疗器械上市后监督系统填写上市后信息。
* 该上市后监督系统会显示:
1. 厂家更新的安全注意信息
2. 经销商上传的召回信息
3. 临床使用机构更新的产品缺陷信息
上市后信息录入系统向公众开放。
* 俄罗斯医疗器械注册上市后监督新要求
法规号 | 生效日 | 涉及产品 | 要求 | 执行人 |
第1113号法规 | 2022年2月 | IIb类植入 和III类 | 递交上市后临床跟踪报告(前3年每年递交) | 制造商/俄代 |
第12020号法规 | 2022年3月 | 所有类别 | 在进口俄罗斯的15天内向RZN报告(批号、工厂信息等) | 制造商/经销商 |
(高风险类产品上市后前三年进行上市后临床跟踪PMCF)
俄罗斯医疗器械简化注册(1930个产品)
简化注册流程:
注:请注册前查阅《俄罗斯快速注册产品清单》,确定产品实用性。
简化注册常见问题:
* 测试:RZN根据产品紧急情况,可能简化测试过程(如,直接认可已有的测试报告、缩短测试周期、减少测试样本)
* 临床:简化注册时,将已有临床数据一并递交,RZN可能根据简化的临床过程(如、直接认可已有的临床报告,或缩短测试周期、减少测试样本)
* 周期约4-8个月
* 证书有效期:2025年1月


 返回列表
返回列表